|
|
Pierwsza zasada termodynamiki
|
| Jeśli praca lub ciepło są dostarczane do ciała (układu
ciał), to są one liczone ze znakiem plus - są dodatnie. | |
| Jeżeli są odbierane od ciała (układu ciał) , czyli jeśli to ciało/układ wykonuje jakąś pracę, to odpowiednie wartości będą ujemne. |
Przykłady:
1. Proste zastosowanie wzoru
Podczas prasowania żelazko podgrzało tkaninę energią 200 J, a w wyniku tarcia została do niego dodatkowo dostarczona energia 10 J (zakładamy, że nie było ubytków ciepła). W rezultacie energia wewnętrzna tkaniny wzrosła o:
∆U = Q + W = 200 J + 10 J = 210 J
2. Podgrzewanie ciała, bez wykonywania pracy
Podczas podgrzewania ciała bez wykonywania pracy (np. podczas podgrzewania wody na herbatę) mamy:
Q > 0 (bo ciepło jest dostarczane do ciała /
układu)
W = 0 (bo praca nie jest wykonywana ani przez siły zewnętrzne,
ani przez układ)
∆U = Q + 0 = Q > 0 - energia wewnętrzna układu
wzrasta (czyli najczęściej także wzrasta temperatura).
3. Oziębianie ciała, bez wykonywania pracy
Podczas oziębiania ciała bez wykonywania pracy (np. podczas chłodzenia masła w lodówce) mamy:
Q < 0 (bo ciepło jest odbierane od ciała / układu)
W = 0 (bo praca nie jest wykonywana ani przez siły zewnętrzne,
ani przez układ)
∆U = Q + 0 = Q < 0 - energia wewnętrzna układu
maleje (czyli najczęściej także maleje temperatura).
4. Podgrzewanie ciała z wykonywaniem pracy przez siły zewnętrzne
Podczas podgrzewania ciała wraz z wykonywaniem pracy (np. podczas uderzania młotem kowalskim w kawał żelaza ogrzewany w palenisku w kuźni) mamy:
Q > 0 (bo ciepło jest dostarczane do ciała /
układu)
W > 0 (praca jest wykonywana siły zewnętrzne - kowala)
∆U = Q + W > 0 - energia wewnętrzna układu rośnie
(w opisanym przykładzie rośnie temperatura żelaza).
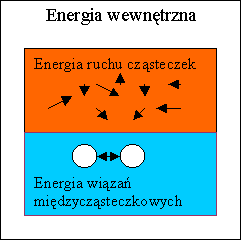
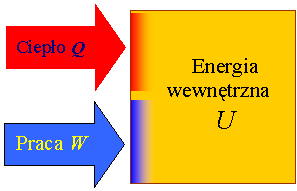 Pierwsza zasada
termodynamiki precyzuje zależność zmiany
Pierwsza zasada
termodynamiki precyzuje zależność zmiany